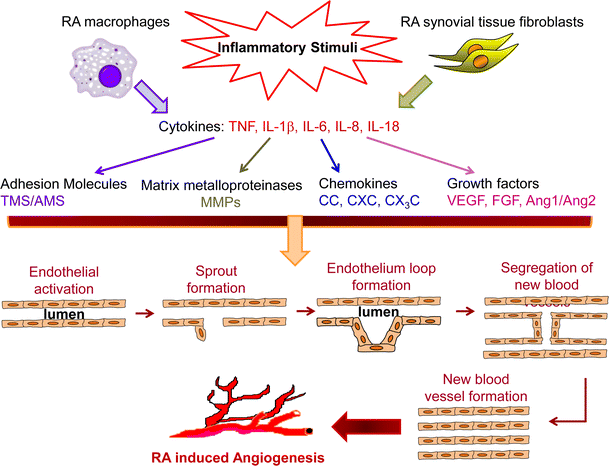
رگ زایی، به معني تشکيل مويرگهاي خونی جديد از عروق اوليه است. این فرآیند در حالات مختلف پاتولوژيک از قبيل رشد تومور، متاستاز، بیماریهای خودایمن مانند آرتريت روماتوئید[1] و همچنين در فرآيندهاي فيزيولوژيک مانند رشد و نمو اندام، ترميم زخم و توليد مثل دخالت دارد . اساساً، آنژيوژنز يك فرايند لازم در فيزيولوژي طبيعي است و در صورتيكه تعادل بين فاكتورهاي القاء كننده و مهار كننده آنژيوژنز بر هم خورد، شرايط برای بروز برخی بيماريها بوجود می آید. بطور کلی، برای فهم فرایند آنژیوژنز 10 مرحلۀ متوالی در نظر گرفته می شود (شکل 1) که یک یا چند مرحله از این مراحل میتواند هدف عوامل محرک و یا بازدارنده آنژیوژنز باشد. کلیات این مراحل به این صورت است: هنگامیکه بافتها به دلایلی مثل بیماری یا آسیب دچار هایپوکسی[2] (كمبود اكسيژن) می شوند، اقدام به تولید و رهاسازی فاکتورهای آنژیوژنیک مینمایند. فاکتورهای مذکور سپس با اتصال به گیرنده های خود واقع بر روی سلولهای اندوتلیال عروق منجر به فعالشدن آنها می شوند. در مرحله بعد، پروتئازها از سلولهای اندوتلیال رها شده و غشاي پایه را حل می کنند. با هضم غشاي پایه، سلولهای اندوتلیال اقدام به مهاجرت و تکثیر می نمایند. علاوه بر این، مولکولهای چسبان (از قبیل اینتگرین αvβ5 و αvβ3) نیز کمک به کشیدن و جلو رفتن رگهاي خونی در حال جوانه زدن می کنند. در ادامه این فرایند، آنزیمهایی به نام ماتریکس متالوپروتئینازها(MMP) [3] جهت تجزیه ماتریکس خارج سلولی و آغاز بازسازی مجدد آن تولید می گردند. سپس، با برهمکنش آنژیوپوئیتین-Tie-2 (مجموعه فاكتورهاي رشد پروتئيني آنژيوپوئيتين كه به گيرنده هاي تيروزين كينازي خود يعني Tie در هنگام پيام رساني داخل سلولي متصل مي شوند) فرایند تشکیل لوله آغاز می گردد. در مرحله بعد نیز سیستم EphB-ephrinB، كه به عنوان پروتئينهاي سطح سلولي وظيفه انتقال دوطرفه سيگنالهاي مهم رشد و نمو را پس از تماس سلول- سلول بر عهده دارند، نیز فرایند تشکیل لوپها را تنظیم کرده و در نهایت پریسیت ها و سلولهای ماهیچۀ صاف برای پایدار کردن رگ خونی تازه تشکیل شده به این ساختار اضافه می شوند .
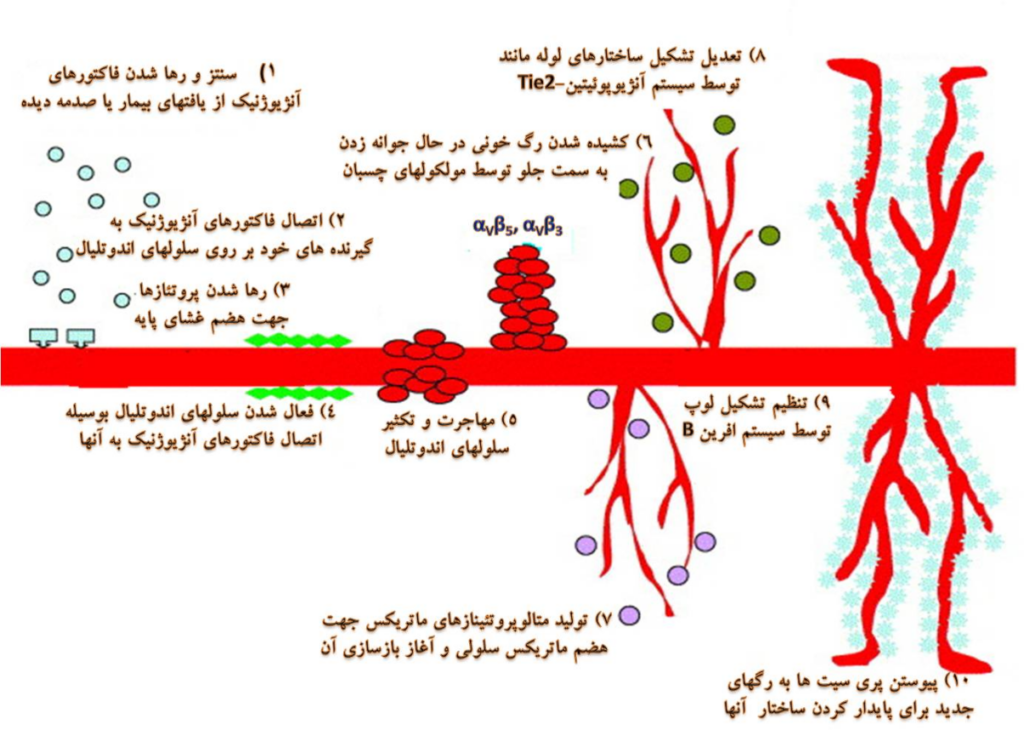
شکل 1. مراحل آنژیوژنز. در این شکل بطور كلي وقایع اصلی سلولی و مولکولی نشان داده شده اند. عروق تازه تشكيل شده در نهایت، یا در جهت ساختار شبكه اي دستخوش بلوغ شده یا به خاطر حفظ تراکم عروقی اولیه دچار پسرفت و اضمحلال می گردند.
تاریخچۀ شناخت و اهمیت آنژیوژنز
هر چند واژه آنژیوژنز برای اولین بار توسط محققی بنام Hertig در سال 1935 به کار رفت، اما اساس بسياري از تحقيقات بنیادی آنژيوژنز بر طبق نظريات پروفسور جودا فولكمن[4] بنا نهاده شده است. در سال 1971، فولمكن مقاله اي را در مجلۀ پزشكي نيوانگلند[5] منتشر كرد كه تئوري جديد آنژيوژنز را بر اساس چندين سال كار و تحقيق مورد بحث قرار می داد. در اين تحقيق، فولكمن خاطر نشان كرد كه “تومورها هرگز فراتر از اندازة مشخصي رشد نمي كنند مگر اينكه عروق آنها افزایش یابد”. در اين مقاله، او همچنين نظريه اي را مطرح كرد كه تومورها داراي رگهاي خوني جديدي هستند كه فاكتوری قابل انتشار، كه او از آن به عنوان فاكتور آنژيوژنزي تومور (TAF)[6] ياد مي كند، را به همین منظور به كار مي گيرند. در نهايت، او اظهار داشت كه” از لحاظ تئوري، اگر بتوان آنژيوژنز را مهار نمود، تومورها در اندازه كوچك باقي مي مانند و سرانجام آسيب رسان نخواهند شد” . نظرية جديد فولكمن همچون ساير نظريات، ابتدا با بدبيني زيادي از سوي جامعۀ علمي مواجه شد و پذيرش آن نزديك به يك دهه به طول انجاميد. اکنون، پس از گذشت بيش از پنج دهه از انتشار تئوري فولکمن، آنژيوژنز تومور بعنوان يك اصل اساسي در تحقيقات مربوط به سرطان همچنان مورد توجه خاص محققان است.
فیزیولوژی فرآیند آنژیوژنز در بدن و نقش سلولهای اندوتلیال در آن
تا مدتهاي طولانی، نقش رگهاي خوني در بدن فقط به عنوان ساختار انتقال دهندۀ خون مورد توجه بود. امروزه، محققان معتقدند كه تشکیلات عروقی نیز بايد يكي از اندام هاي اصلي در بدن محسوب گردد كه بيش از 900 متر مربع گسترش داشته و نقشی عمده در حفظ و نگهداري سلامت بدن دارد. رگهاي خوني از سلولهاي اندوتليال، كه در تماس مستقيم با خون هستند، و پريسيت ها كه در زير اندوتليال ها قرار مي گيرند و همينطور سلولهاي ماهيچه صاف، فيبروبلاست ها، غشاي پايه و ماتريكس خارج سلولي تشكيل شده اند. برحسب موقعيت، محيط و اجزاي سلولي هر اندام، پدیده عروق زایی در تركيب، فنوتيپ و عملكرد متفاوت خواهد بود .
سلولهاي اندوتليال يك لايه پیوسته سلولی در سطح داخلی عروق هستند كه به طور فعال در فرآيندهاي تنظيمي مختلف در بدن دخالت دارند (شكل 2). سلولهاي اندوتليال از طریق توليد فاکتورهایی مثل ترومبومدولين[7]، مهار كنندۀ مسير فاكتور بافتي[8] و فعال كننده پلاسمينوژن نوع بافتي (t-PA)[9] فعالیت ضد انعقادي خود را انجام مي دهند. با فعال شدن يا آسيب دیدن سلولهاي اندوتليال، این سلولها سريعاً پروتئينهايي چند واحدي مثل فاكتور فون ويلبراند (vWF)[10] را آزاد مي سازند كه موجب اتصال و تجمع پلاكتي و مهار كنندۀ نوع 1 فعال كنندۀ پلاسمينوژن[11] (عضوي از خانواده سرپين) می گردند. علاوه بر اين، بيان فاكتور بافتي (TF)[12] توسط سلولهای اندوتلیال منجر به آغاز شدن مسير خارجي انعقاد خون مي شود. بيان القاء شدة مولكولهاي اتصال سلولي مثل سلكتينِ E و مولكول چسبان بين سلولي ICAM-1 كه بيان آنها توسط سايتوكاينها القاء شده و همينطور فاكتورهاي محلول از قبيل جذب كننده هاي شيميايي، سايتوكاينها و كموكاينها با همکاری یکدیگر براي جلب و بكارگيري سلولهاي ايمني به سوی اندامهاي لنفوئيدي يا جايگاههاي التهابي عمل می کنند.
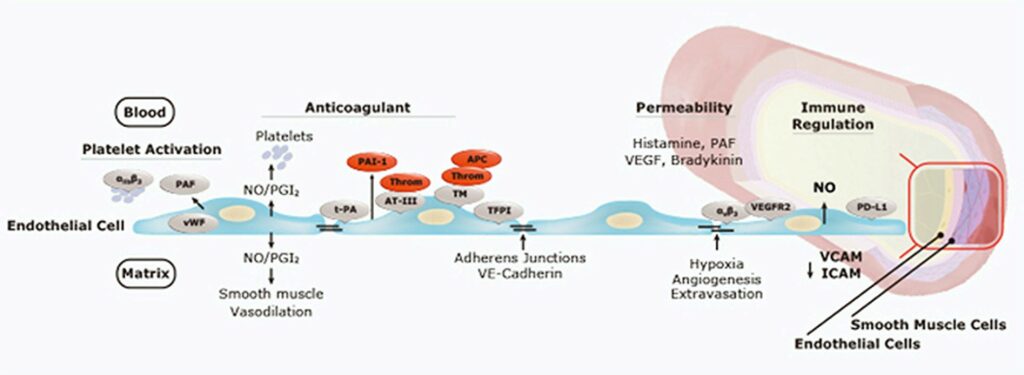
شکل 2. سلولهای اندوتلیال اعمال مهم و متعددی را در بدن انجام می دهند. 1) ایجاد نفوذپذیری انتخابي جهت انتقال پپتیدها ، پروتئینها و دیگر مولکولهای محلول به سوی بافت زیرین، 2) شرکت فعال در هموستاز بدن از طریق تنظیم فعالیتهای تحریكی و مهاری انعقاد خون، 3) افزایش بیان انواعی از مولکولهای چسبان سلولی برای فراخواني لوکوسیتها و تسهیل اتصال و مهاجرت آنها از خون به بافتها تحت اثر سایتوکاینهای التهابي و 4) نقش فعال در ترمیم زخم و رشد تومور در طی آنژیوژنز.
نقش آنژيوژنز در التهاب مزمن
مطالعات متعدد نشان مي دهند كه لوكوسيت ها مي توانند موجب القاي رشد و گسترش عروق گردند و حتی در این زمینه نیز سايتوكاينهاي ويژه مشتق از لوكوسيتها شناسايي شده اند كه موجب تحريك آنژيوژنز مي شوند. در مقابل، فرايندهاي آنژيوژنيك نيز مي توانند اثر عمده اي بر روي سلولهاي سيستم ايمني و پیشرفت يك پاسخ ايمني داشته باشند. سلولهاي اندوتليال طبيعي با بيان مولكولهاي چسبان، در جذب و بكارگيري سلولهاي ايمني به سوی مكان التهاب شركت مي كنند و خانواده هاي مختلف مولكولهاي چسبان در اين فرايند ایفای نقش مي كنند. مهمترين خانواده هایی که تا به حال مورد شناسايي قرار گرفته اند از اين قرارند: 1) مولكولهايی از قبيل ICAM-1، VCAM-1، 2) سلكتين ها، و 3) مولكولهای CD34 و CD31 .
بيان مولكولهاي چسبان سلولهای اندوتليال توسط سایتوكاينهايي از قبيل TNF، IL-1 و اینترفرونها كنترل مي گردد. اين سايتوكاينها اتصال لوكوسيت را به سلولهاي اندوتليال و خروج مواد از مجراي اصلي طبيعي به سمت بافتها را با تحریک افزایش بيان ICAM-1، VCAM-1 و سلكتين-E تسهيل مي كنند. در معرض قرار گرفتن سلولهاي اندوتليال با فاكتورهاي آنژيوژنيك موجب كاهش بيان مولكولهاي چسبان مي شود. علاوه بر اين، القاي بيان مولكول چسبان توسط سايتوكاينهاي محرك التهاب TNF، IL-1 يا اینترفرونها شديداً مختل مي شود، پديده اي كه به آنرژي يا بي رمقي سلول اندوتليال معروف است. شواهد موجود نیز نشان داده اند که برهمكنش بین ديواره رگ- لوكوسيت در تومورها كاهش می یابد. مطالعاتی که به شناسايي بيولوژي تومورها می پردازند، از اهمیت ويژه اي برخوردارند، زيرا اين پديده ها در فرار تومورها از مراقبت سيستم ايمني دخیل هستند. بنابراین، مهار آنژيوژنز ممكن است موجب افزايش بيان مولكولهاي چسبان و آنرژي سلول اندوتليال در تومورها شده و از اين رو موجب بازيابي پاسخ سلول هاي اندوتليال و افزايش عمل ارتشاح لوكوسيتها گردد.
اخيراً نیز با مطالعات بيشتر در مورد نقش VEGF و FGF در برهمكنش هاي بين ديواره رگ- لوكوسيت مشخص شده كه به طور كلي القاي قوي آنژيوژنز موجب مهار اتصال لوكوسيت مي گردد. اهميت این تحقيقات به خصوص در مشخص کردن بيولوژي تومور مي باشد زيرا اين پديده ها در رهايي تومورها از دست مراقبت ايمني دخیل هستند. مهار آنژيوژنز ممكن است با كاهش بيان مولكولهاي چسبان و آنرژي سلول اندوتليال در تومورها مقابله كند و از اين رو موجب بازيابي پاسخ سلول هاي اندوتليال شده و افزايش عمل ارتشاع لوكوسيتها گردد.
نقش واسطه های التهابي در آنژيوژنز
مولكولهاي مؤثر در پديده ارتشاح لوكوسيت ها و آنژيوژنز در تومورهاي جامد شامل سايتوكاين ها، محرك هاي رشد، ممانعت كننده ها، پپتيدهاي وازواكتيو، فاكتورهاي انعقادی و فاكتورهاي فيبرينوليتيك مي باشند.
كموكاينها
كموكاينها متعلق به خانواده ای از سایتوکاینهای کوچک یا پروتئینهای ترشح شده از سلولها هستند که بسیاری از فعاليتهاي آنها به لوكوسيت ها محدود مي شود. مطالعات اخير نشان مي دهند كه بعضي از اعضاي اين واسطه هاي التهابي روي عملكرد سلولهاي التهابي تأثير مي گذارند. IL8،GROα و ديگر كموكاينهاي (موتيف C-X-C) مسئول مهاجرت سلولهاي التهابي و تكثير سلولهاي اندوتليال را در in vitro و آنژيوژنز را در in vivo القاء مي كنند. فاكتور4ِ پلاكتي كه در گرانولهاي آلفاي پلاكتها وجود دارد يك كموكاين C-X-C است كه از تكثير سلولهاي اندوتليال و آنژيوژنز القاء شده توسط فاكتور رشد ممانعت به عمل مي آورد. همچنين، پروتئين IP-10 القاء شده توسط اينترفرون گاما، در شرايط in vivo خاصيت آنژيواستاتيك داشته و در شرايط in vitro از تكثير سلولهاي اندوتليال تحريك شده با bFGF جلوگيري مي كند. پروتئين IP-10 القاء شده توسط اينترفرون گاما از فعاليت آنژيوژنيك IL-12 نيز ممانعت بعمل ميآورد.
سايتوكاين ها
فاکتور نکروز دهنده تومور یا TNF يك سايتوكاين التهابي با تأثير زياد بر روي سلولهاي اندوتليال است و موجب فعال شدن فرایندهای التهابي، ترمبوتيك و آنژيوژنيك در سلولهاي اندوتلیال می گردد. سلولهاي اندوتليال هم گيرنده هاي P55TNF و P75TNF را در سطح خود بيان مي كنند. گيرنده P75 بيشترين تعداد را روي سلولهاي اندوتليال دارد ولي P55 بيشتر در ناحيه دستگاه گلژي و واكوئلهاي سيتوپلاسمي يافت مي شود. سلولهاي اندوتليال از طريق گيرنده هاي P55 وP75 به TNF پاسخ مي دهند. TNF چرخه زندگي سلولهاي اندوتليال و پدیده آنژيوژنز را با عملكردي به ظاهر متناقض تنظيم مي نمايد. TNF براي سلولهاي اندوتليال فاكتور رشد نيست اما در شرايط in vitro باعث مهاجرت سلولهاي اندوتليال و در شرايط in vivo و in vitro باعث تحریک آنژيوژنز مي شود و اين عملكرد ممكن است به صورت غير مستقيم باشد. TNF باعث القاي پروتئين B.61 مي گردد كه بعنوان جاذب شيمیايي و فاكتور آنژيوژنيك عمل كرده و ليگاندي براي رسپتور تيروزين كيناز است. فاكتور فعال كننده پلاكتي (PAF) و نيتريك اكسيد بعد از در معرض قرار گرفتن سلولهاي اندوتليال با TNF توليد شده كه به اثر آنژيوژنيك آن مربوط مي شود. این مولکول همچنین بيان اوروكيناز و گيرنده آن را افزايش مي دهد و از آنجايي كه تخريب پروتئين هاي ماتريكس خارج سلولي مرحله اي كليدي در آنژيوژنز است، افزایش اوروكيناز جهت آنژيوژنز تحت شرايط in vitro توسط سلولهاي اندوتليال ميكروواسكولار انساني كه با VEGF-A يا bFGF تحريك شده اند، لازم است و uPA به شكل غير فعال بهuPA-R متصل مي شود و سپس به صورت فعال در مي آيد كه قادر به تخريب ماتريكس خارج سلولي و فعال كردن متالوپروتئينازهاي ماتريكس خارج سلولي است.
فاكتور محرك كلني گرانولوسيت ها و مونوسیت ها (GM-CSF)
GM-CSF يك گليكوپروتئين است كه رشد و تمايز سلولهاي اجدادي را تنظيم مي كند و با تمايز اين سلولهاي اجدادي به مونوسیت و گرانولوسيت در جريان دفاع ميزبان نقش دارد. اين گليكوپروتئين توسط سلولهاي ايمني و سلولهاي مزانشيمی موجود در مغز استخوان كه شامل اندوتليوم و فيبروبلاست است توليد مي شود. مطالعات متعددي نشان مي دهند كه پاسخ به GM-CSF محدود به رده هماتوپويتيك نمي شود و سلولهاي اندوتليال هدف ديگری براي اين سايتوكاين مي باشند.
فعال شدن اندوتليوم بواسطه GM-CSF منجر به آنژيوژنز و التهاب خواهد شد (يعني تكثير، مهاجرت، عرضه مولکولهاي چسبان). اگر چه GM-CSF قدرت كمتري نسبت به مولکولهاي آنژيوژنيك يعني FGF در تكثير سلولهاي اندوتليال دارد ولي فنوتيپ مهاجرت را كاملاً فعال مي كند. این گليكوپروتئين عرضه mRNA.C.fos را نیز افزايش مي دهد. علاوه بر این، مشخص شده که سايتوكاين هاي ديگري كه روي سلولهاي هماتوپويتيك عمل مي كنند روي عملكرد سلولهاي اندوتليال در رابطه با آنژيوژنز و التهاب تأثير مي گذارند و تعداد زيادي از مولکولهاي آنژيوژنيك روي خونسازی اثر مثبت يا منفي دارند. بنابراين، توانايي GM-CSF و ديگر مولكولهاي شبيه آن كه براي القاي مهاجرت و تكثير سلولهاي اندوتليال در مغز استخوان وجود دارند مي تواند براي زنده ماندن و تجديد ساختار محيط سلولي در شرايط فيزيولوژيكی و پاتولوژيكی ضروري باشد.
[1]. Rheumatoid arthritis[2]. Hypoxia[3]. Matrix metalloproteinases[4]. Judah Folkman[5] .New England Journal of Medincine[6]. Tumor angiogenic factor[7]. Tthrombomodulin[8]. Ttissue factor (TF) pathway inhibitor[9]. Ttissue-type plasminogen activator[10]. Von Willebrand factor[11]. Plasminogen activator inhibitor-1[12]. Tissue factor
جهت مطالعه بیشتر
Jeong Jh, Ojha U, Lee YM. Pathological angiogenesis and inflammation in tissues (Review). Arch. Pharm. Res. (2021) 44:1–15.

