پروتئینها از مهمترین ترکیبات آلی موجود در ساختار سلولها و بافتها هستند که درمحدوده وزنی چند هزار (برخی هورمونهای پروتئینی) تا چند میلیون (برخی پروتئینهای عضلات) دالتون قرار دارند. برای ساخت همه اشکال محلول و نامحلول پروتئین، زیرمجموعهای از 20 نوع اسید آمینه استفاده میشود. کربن، اکسیژن، نیتروژن و هیدروژن عناصر مشترک در ساختمان همه اسیدهای آمینه هستند که بطور میانگین، به ترتیب 53، 23، 16 و 7 درصد وزن پروتئین را به خود اختصاص میدهند. عناصری مانند گوگرد یا فسفر که در ساختمان برخی اسیدهای آمینه دیده میشوند، کمتر از یک درصد وزن پروتئین را به خود اختصاص میدهند.
با توجه به اهمیت جداسازی و یا کاربرد پروتئین در کلیه رشتههای علوم زیستی بویژه علوم بیوشیمی، شیمی پروتئین، زیست شناسی سلولی و مولکولی، بیوتکنولوژی، علوم آزمایشگاهی، علوم دامی، علوم گیاهی، تغذیه و صنایع غذایی، داشتن اطلاعات کافی از میزان یا غلظت پروتئین در واحد وزن یا واحد حجم ماده اهمیت دارد و در این راستا اهمیت انتخاب روش مناسب سنجش پروتئین کاملاً روشن است. برای مثال، هنگامی که میزان پروتئین موجود در آرد گندم برای تولید ماکارونی، یا غلظت پروتئین در مراحل مختلف تخلیص یک پروتئین دارویی از پلاسما اندازهگیری میشود، بسته به شرایط و هدف کار، نوع فرآورده مورد آزمون و دقت مورد نیاز، روش مناسبی برای تعیین مقدار یا غلظت پروتئین مدنظر قرار میگیرد. از آنجا که اغلب پروتئینهای دانه گندم در حلالهای آبی نامحلول هستند، امکان انتخاب روش اندازهگیری پروتئین محدودتر از اندازهگیری پروتئینهای پلاسما است که در حلالهای آبی محلول هستند. با توجه به تفاوت شرایط دو مثال فوق، انتخاب روش “کجلدال” گزینه مرسوم و مناسبی برای تعیین مقدار پروتئین در آرد گندم است. در مقابل، برای اندازهگیری پروتئین در پلاسما معمولاً از انواعی از روشهای رنگسنجی متداول همچون روش “لوری” یا روش “برادفورد” میتوان استفاده نمود. در این مجال، سعی میشود اطلاعاتی کلی در مورد روشهای متداول سنجش پروتئین، تناسب روشها برای اندازهگیری پروتئین در نمونههای مختلف و نقاط قوت و ضعف آنها، به نظر خوانندگان برسد. در ابتدا، ذکر این نکته ضروری است که این روشها بطور معمول برای اندازهگیری همه انواع پروتئین (پروتئین تام) در یک نمونه زیستی مانند یک نوع دانه، عصاره یک نوع گیاه یا یک مایع زیستی بکار میروند و با آنها نمی توان میزان یک پروتئین مورد نظر را اندازهگیری نمود، مگر در مواردی که پروتئین خالص است یا درجه خلوص بالایی دارد. اندازهگیری میزان یا غلظت یک پروتئین خاص، نیازمند یک روش مناسب اختصاصی مانند انواعی از روشهای فعالیت سنجی، بیوشیمی یا ایمونوشیمی است که توضیحات آنها هدف بحث حاضر نیست.
روش کجلدال (یا کلدال) از قدیمیترین (1883) روشهای تعیین مقدار پروتئین است که مبنای اندازهگیری آن، میزان نیتروژن موجود در مواد آلی از جمله پروتئینها است. عنصر نیتروژن، غیر از اسیدهای آمینه، در ساختار برخی ترکیبات آلی دیگر نیز وجود دارد. بدین لحاظ، درصد نسبی این ترکیبات غیرپروتئینی می تواند به همان نسبت باعث انحراف در تعیین مقدار پروتئین به روش کجلدال گردد. در شکل اولیه یا اشکال تغییر یافته روش کجلدال، ابتدا نمونه در اسید سولفوریک با کمک حرارت بالا (300 درجه سانتیگراد یا بالاتر) و کاتالیزورهای فلزی بطور کامل تجزیه و نیتروژن موجود در نمونه، به سولفات آمونیوم تبدیل میگردد. در مرحله بعد که به مرحله “تقطیر” معروف است، نیتروژن موجود در سولفات آمونیم در واکنش با هیدروکسید سدیم و اسید بوریک، به بورات آمونیوم تبدیل میشود. تیتراسیون بورات آمونیوم با اسید کلریدریک رقیق مبنای تعیین میزان نیتروژن و تخمین پروتئین (معمولاً به درصد) در این روش است. از آنجا که محتوای نیتروژن ماده آلی مبنای اندازهگیری در روش کجلدال است، حلالیت یا عدم حلالیت پروتئین محدودیتی برای این روش محسوب نمی شود. بدین لحاظ به عنوان یک روش مرجع برای تعیین مقدار پروتئین در مواد غذایی و حتی محلولهای زیستی قابل استفاده است. وجود عنصر نیتروژن در سایر مواد آلی غیرپروتئینی همچون اسیدهای نوکلئیک، برخی قندها، برخی چربیها و حتی برخی افزودنیها به مواد غذایی از عوامل مداخلهگر در روش کجلدال است. بعلاوه، طولانی بودن روش، تولید گازهای سمی ناشی از واکنش موادی مانند اسید سولفوریک، نیاز واکنش به درجه حرارتهای بالا و هدر رفتن نمونه پروتئین (بخصوص در صورت ارزشمند بودن نمونه) از دیگر محدودیتهای این روش محسوب میشود.
برای اندارهگیری غلظت پروتئین در محلول، چندین روش رنگ سنجی یا اسپکتروفتومتری در محدوده نور ماورای بنفش (UV) و نور مرئی ابداع شده است. جذب ذاتی پروتئین در محدوده نور ماورای بنفش و چهار روش رنگسنجی در محدوده نور مرئی شامل روش بیوره (Biuret assay)، روش لوری (Lowry assay)، روش اسید بیسین کونینیک (bicinchoninic acid assay) و روش برادفورد (Bradford assay) از شناختهترین این روشها هستند که به اختصار توضیحاتی در مورد اساس رنگسنجی، حساسیت و نقاط ضعف و قوت آنها خواهد آمد. روشهای اندازهگیری پروتئین با مواد فلورسانس همچون برموکرزول سبز از روشهای جدیدتر اندازهگیری پروتئین است که در این مجال به آنها پرداخته نمیشود.
نور ماورای بنفش، به بخشی از طیف الکترومغناطیس در محدوده طول موجهای 10 تا 400 نانومتر اطلاق میشود. این محدوده که در حدفاصل اشعه ایکس و نور مرئی قرار دارد، خود به مناطق “بسیار دور” (نزدیک اشعه ایکس)، “دور” (100 تا 200 نانومتر)، “حدوسط” (200 تا 300 نانومتر) و “نزدیک” (نزدیک نور مرئی) تقسیم میشود. با توجه به رفتار ذاتی پروتئینها در برابر نور ماورای بنفش از یک طرف و دقت اسپکتروفتومترهای آزمایشگاهی در تولید و خوانش طول موجهای نور ماورای بنفش از طرف دیگر، جذب نور ماورای بنفش در محدوده 200 تا 300 نانومتر برای اندازهگیری غلظت پروتئین قابل استفاده است. پیوندهای پپتیدی موجود در ساختار پروتئینها قابلیت زیادی در جذب نور ماورای بنفش در محدوده 190 تا 210 نانومتر دارند. بدان معنی که اصطلاحاً “ضریب خاموشی” یا “ضریب جذب مولی” آنها در این طول موجها بسیار بالا است. برای مثال، محلول با غلظت یک میلیگرم در میلیلیتر اغلب پروتئینها جذبی معادل 35-30 واحد در طول موج 205 نانومتر یا جذبی معادل 24-20 واحد در طول موج 210 نانومتر دارد. برغم این ضریب خاموشی بالا، اندازهگیری غلظت پروتئین در این محدوده چندان عملی نیست. این محدودیت، از یک طرف ناشی از قابلیت جذب بالای برخی بنیانهای اسیدهای آمینه (همچون متیونین، تریپتوفان، هیستدین، سیستئین، آرجینین)، انواعی از ترکیبات بافری، کوفاکتورها، لیپوپلیساکاریدها، دترجنتها و انواعی از متابولیت های ثانویه، و از طرف دیگر ناشی از عدم دقت اسپکتروفتومترهای آزمایشگاهی در این طول موجها است.
جذب ذاتی پروتئینها در محدوده 280-270 نانومتر عمدتا به دلیل حضور بنیان دو اسید آمینه تریپتوفان و تیروزین و به میزان بسیار کمتر به دلیل وجود فنیل آلانین و پیوندهای دیسولفیدی (سیستین) در ساختمان پروتئین است. بنابراین، از نظر تئوری ضریب خاموشی مولی پروتئین در طول موج 280 نانومتر تابع فرمول زیر است (Y، Wو C به ترتیب اختصار تریپتوفان، تیروزین و سیستین).
ε = (nW×5500) + (nY×1490) + (nC×125)
با توجه به توضیحات فوق، میزان جذب محلول پروتئین در طول موج 280 نانومتر، یکی از روشهای سریع و عملی اندازه گیری پروتئین است. از آنجا که در اغلب محلولهای پروتئین، اسیدهای نوکلئیک هم بهمیزان کم یا زیاد وجود دارد، ابتدا جذب محلول در دو طول موج 260 و 280 نانومتر قرائت میشود. سپس با قرار دادن نتایج در معادله زیر، غلظت پروتئین برحسب میلیگرم در میلیلیتر بدست می آید(روش واربورگ-کریستین). محاسبه جذب محلول در طول موج 260 نانومتر به خاطر به حداقل رساندن اختلال ناشی از وجود اسیدهای نوکلئیک در محلول است.
Protein (mg/ml) = 1.55 (A280) – 0.76 (A260)
با توجه به محتوای متفاوت انواع پروتئینها از نظر وجود تریپتوفان و تیروزین، محلول با غلظت یک میلیگرم در میلیلیتر پروتئینهای مختلف ممکن است جذبی از صفر تا 4 واحد در طول موج 280 نانومتر داشته باشند. این موضوع میتواند منشا خطای بزرگی در محاسبه غلظت پروتئین هایی شود که محتوای تریپتوفان و یا تیروزین آنها بسیار کم (مانند کلاژن) یا بسیار زیاد (مانند برخی پروتئینهای مشتق از پشم) است.
در حالتی که محلول مورد آزمایش حاوی یک نوع پروتئین با درجه خلوص بالا (مثلا بیش از 90 درصد) یا خالص است، با قرائت جذب محلول در 280 نانومتر و اطلاع از ضریب خاموشی پروتئین (ضریب جذب درصد یا مولی در همان طول موج) میتوان غلظت دقیق پروتئین را محاسبه نمود (طبق معادله پایین). این معادله که همان قانون بیر_لامبرت در رنگسنجی است، در محدوده خطی (y=ax) نتایج قابل اعتمادی دارد. l، c و εدر این معادله به ترتیب اختصار طول مسیر عبور نور (یک سانتیمتر)، غلظت پروتئین (مولار) و ضریب جذب مولی است.
A (absorbance) = εcl
بطورکلی، سنجش پروتئین به روش جذب در نور ماورای بنفش، روشی سریع، ساده و کم هزینه است و به معرف خاصی نیاز ندارد. بعلاوه، پروتئین در این روش از دست نمی رود. با این حال، اختلال ناشی از وجود انواعی از ترکیبات غیرپروتئینی، عدم تشابه انواع پروتئینها از نظر محتوای اسیدهای آمینه و تفاوت ساختار سهبعدی انواع پروتئینها از محدودیتهای این روش محسوب میشود. بعلاوه، این روش برای اندازهگیری سوسپانسیونهای پروتئینی (همچون شیر) قابل استفاده نیست.
همانگونه که در توضیحات صفحه قبل آمد، چهار روش بیوره (Biuret assay)، لوری (Lowry assay)، اسید بیسین کونینیک (bicinchoninic acid assay) و برادفورد (Bradford assay) از شناختهترین روشهای سنجش پروتئین در محدوده نور مرئی هستند. اساس رنگآمیزی پروتئین در سه روش بیوره، لوری و اسید بیسین کونینیک اتصال یون مس دوظرفیتی به پروتئین و احیای آن به یون مس یک ظرفیتی توسط باندهای پپتیدی است. در روش بیوره با اتصال یون مس به پروتئین تحت شرایط قلیایی شدید، کمپلکس بنفش رنگی تولید میشود. این واکنش رنگی متاثر از نوع اسیدهای آمینه سازنده پروتئین نیست، ولی وجود بافر تریس، یون آمونیوم، ساکارز، آمین های نوع اول و گلیسرول از عوامل مزاحم سنجش هستند. شکل اولیه روش بیوره که قدیمیتر از سایر روشها است، حساسیت پایینی دارد و کاربرد آن محدود است. اشکال اصلاحشده این روش، حساستر شده و کاربرد بیشتری پیدا نمودهاند.
روش لوری در سال 1951 میلادی معرفی گردید. این روش شکل تغییریافتهای از روش بیوره است که حساسیت آن با افزودن واکنش مرحله دوم توسط معرف فنل فولین (معرف فولین-سیکالتو) تقویت شدهاست. در شکل مرسوم این روش، ابتدا معرف لوری (مخلوطی از سه نوع محلول با نسبتهای حجمی خاص) به لولههای حاوی نمونه و پروتئین استاندارد (آلبومین گاوی) اضافه میشود. در مرحله بعد، پس از افزودن معرف فولین به لولهها و انکوباسیون، جذب در طول موج 600-595 نانومتر قرائت و غلظت پروتئین براساس منحنی استاندارد محاسبه میشود. انواعی از دترجنتها (مانند تریتون X-100 و NP-40)، عوامل احیاکننده (مانند 2-مرکاپتواتانل و دی تیوتریتول)، عوامل کیلات (مانند EDTA، سیترات و EGTA)، بافرهای آمیندار و انواعی از ترکیبات فنلی گیاهی از عوامل مداخلهگر در روش لوری هستند. برغم متعارف بودن روش لوری در گذشته، امروزه مقبولیت و کاربرد این روش کمتر شده است.
روش اسید بیسین کونینیک (BCA) در سال 1985 توسط اسمیت و همکاران ارائه گردید. این روش، شکل تغییریافتهای از روش لوری است. در این روش، اسید بیسین کونینیک به عنوان جایگزین معرف فولین-سیکالتو، با یونهای مس متصل شده به باندهای پپتدی در شرایط قلیایی، واکنش میدهد و کمپلکس بنفش رنگی در انتهای واکنش ایجاد میکند. در شکل فعلی این روش، تنها از یک معرف (معرف کاری استاندارد) استفاده میشود.حجم مورد نیاز این معرف قبل از انجام آزمایش، از مخلوط نمودن دو محلول پیشساز تهیه میشود. پس از افزودن معرف به لولهها (نمونهها و استاندارد) و انکوسیون 30 دقیقهای در دمای 60 درجه سانتیگراد، جذب نمونهها پس از خنک شدن، در طول موج 562 نانومتر قرائت میشود. ظهور رنگ در این روش متاثر از pH، درجه حرارت و زمان واکنش است. بدین لحاظ انجام واکنش در دمای 60 درجه سانتیگراد باعث تولید حداکثر رنگ در کمترین زمان انکوباسیون میشود. ترکیبات کیلات (با برداشتن یونهای مس)، قندهای احیاکننده (همچون فروکتوز، گلوکز یا لاکتوز)، آب اکسیژنه، انواعی از بافرهای زویتریونی، مواد احیاکننده (همچون 2-مرکاپتواتانل و دی تیوتریتول)، برخی دترجنتها (مانند توین 20 و توین 80)، آمینهای بیولوژیک (مانند کتکولآمین، دوپامین و آدرنالین) و برخی آنتی بیوتیکها (همچون پنیسیلین) از عوامل مداخلهگر در سنجش پروتئین به روش BCA هستند. بطورکلی، روش BCA برغم متاثر بودن از عوامل مداخلهگر فوق، به دلیل حساسیت بالا و کوتاهتر شدن زمان به دلیل یک مرحلهای شدن آزمایش،از روشهای مقبول و پر استفاده در میان روشهای اندازهگیری پروتئین است. بعلاوه نشان دادهاند که این روش گزینه مناسبی برای اندازهگیری پروتئینهای رسوب نموده (همچون پروتئینهای رسوب داده شده ادرار) یا پروتئینهای موجود در سلولهای چسبیده به سطوح است.
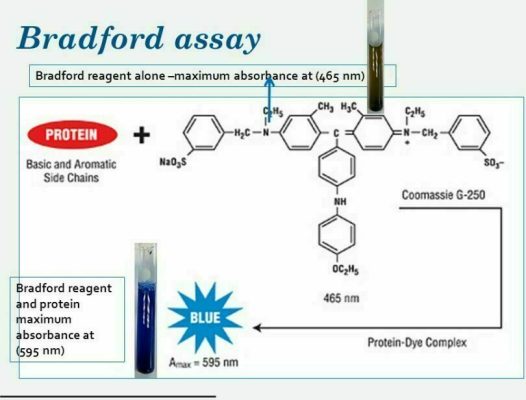
روش برادفورد در سال 1967 میلادی معرفی شد. اساس اندازهگیری پروتئین در این روش، اتصال ماده کوماسی آبی به پروتئین در شرایط اسیدی است. کوماسی آبی درخشان (Coomassie Brilliant Blue) یک ماده رنگی است که برای رنگآمیزی پشم استفاده شده است. این ماده در دو نوع R (سرخ فام) و G (سبز فام) قابل عرضه است. نوع R بیشتر برای رنگآمیزی پروتئین در ژل الکتروفورز و نوع G بیشتر برای سنجش پروتئین استفاده میشود. هر مولکول کوماسی آبی در محیط اسیدی قوی، دو پروتون جذب میکند و محلول آن متمایل به رنگ قرمز میشود. با اتصال کوماسی به مولکولهای پروتئین، پروتونها آزاد میشوند و رنگ محلول به آبی تغییر میکند. ظاهراً اسیدهای آمینه لیزین و آرجینین و بخشهای آبگریز پروتئین در اتصال به کوماسی آبی نقش دارند. سنجش پروتئین به روش برادفورد، یک روش سریع و یک مرحلهای است که برای انجام آن فقط یک معرف کافی است (محلول کوماسی آبی G-250 در اسید ارتوفسفوریک و اتانل). استوک معرف برادفورد را میتوان برای مدتهای طولانی در شرایط مناسب نگهداری نمود. از محدودیتهای عمده روش برادفورد، وابستگی آن به ترکیب اسیدهای آمینه پروتئینها است. برای مثال رنگپذیری آلبومین گاوی که اغلب به عنوان پروتئین استاندارد از آن استفاده میشود، بیش از حد طبیعی است. بعلاوه، رنگپذیری ضعیف پپتیدهای کم وزن و پروتئینهای داری بخش قندی زیاد، از محدودیت های دیگر این روش است. این محدودیت ها در مواردی باعث میشود که غلظت بدست آمده با روش برادفورد بسیار متفاوت از غلظت واقعی پروتئین در مقایسه با روش کجلدال به عنوان روش مرجع باشد. در مقابل، روش برادفورد برخلاف سه روش رنگسنجی قبلی، با حضور دترجنتهایی مانند سدیم دودسیل سولفات یا تریتون X-100 سازگار است، مگر آنکه غلظت آنها بالا باشد. حتی نشان دادهاند که سدیم دودسیل سولفات یا تریتون X-100 در غلظت های پایین به افزایش حساسیت این روش کمک میکنند. انجام روش برادفورد به دو صورت “استاندارد” (معمولاً در لوله) و “حساستر” (معمولاً در میکروپلیت) امکانپذیر است. تنها تفاوت این دو صورت، نسبت حجم معرف به نمونه است که در روش استاندارد 50 برابر و در روش حساستر 10 برابر میباشد. حساسیت روش حساستر حدود ده برابر روش استاندارد است. بطورکلی روش برادفورد برغم محدودیتهای مذکور، روشی سریع، ساده و حساس است که محدوده استفاده ار آن هرروز بیشتر میشود.
منابعی برای مطالعه بیشتر
– Sapan CV, Lundblad RL,Price NC. Colorimetric protein assay techniques. Biotechnol. Appl. Biochem. 1999; 29: 99–108.
– Noble JE, Knight AE, Reason A J, et al. A comparison of protein quantitation assays for biopharmaceutical applications. Mol. Biotechnol. 2007; 37: 99-111.

