یکی از موانع مهم مطالعهی پروتئین، دسترسی به نمونهای با خلوص بالا و دارای فعالیت مناسب از پروتئین است. در مواردی که فعالیت پروتئین مد نظر نیست، داشتن پروتئین واسرشته هم برای مطالعه کافی است. در یک پروتکل خالصسازی، همیشه لازم است غلظت پروتئین تام و پروتئین مورد نظر با روشهای مناسب اندازهگیری شوند. در حالتی که یک مخلوط پروتئینی در روشهای جداسازی در ژل همچون ژل پلی آکریل آمید به اجزای خود تفکیک میشود، لازم است باندها یا لکههای پروتئینی جداشده با روشی مناسب و حساس رنگآمیزی شود.
تشخیص پروتئین در ژل یا غشای بلات نیاز به رنگآمیزی دارد. بعلاوه، رنگآمیزی پروتئینهای جدا شده در ژل مبنایی برای تعیین خصوصیاتی همچون درجه خلوص و وزن مولکولی آنها فراهم میکند. رنگآمیزی پروتئین در ژل، با روشهای رنگسنجی (کالریمتری)، رایوگرافی یا فلورسانس انجام میگیرد. این روشها از نظر ویژگی، حساسیت، تکرارپذیری، سهولت استفاده، پایداری و تطبیق پذیری متفاوت هستند. تشخیص پروتئین در روش SDS-PAGE (به عنوان پراستفادهترین روش الکتروفورز) میتواند با رنگآمیزی با رنگهای آلی یا روشهای رسوب فلز پس از الکتروفورز انجام گیرد. راه دیگر، نشاندارسازی نمونهها با رنگ فلورسانس یا عناصر رادیواکتیو قبل از انجام الکتروفورز است.
فرآیند رنگآمیزی و تثبیت باندهای پروتئینی پس از الکتروفورز شامل این مراحل است: (الف) انتخاب و تهیه رنگ مناسب با کیفیت رضایتبخش، (ب) انتخاب یک حلال برای ایجاد غلظت، حلالیت و پایداری مناسب رنگ، (ج) تثبیت و رنگآمیزی باندهای پروتئینی درون ژل برای تولید یک کمپلکس رنگ-پروتئین پایدار، (د) حذف رنگ آزاد اضافی برای بیرنگ شدن زمینه و وضوح رنگ باندهای پروتئین، و) ثبت دائمی الگوی باندها با عکاسی یا اسکن با چگالیسنج یا اسپکتروفتومتر، و (ه) نگهداری ژل برای مراجعات بعدی.
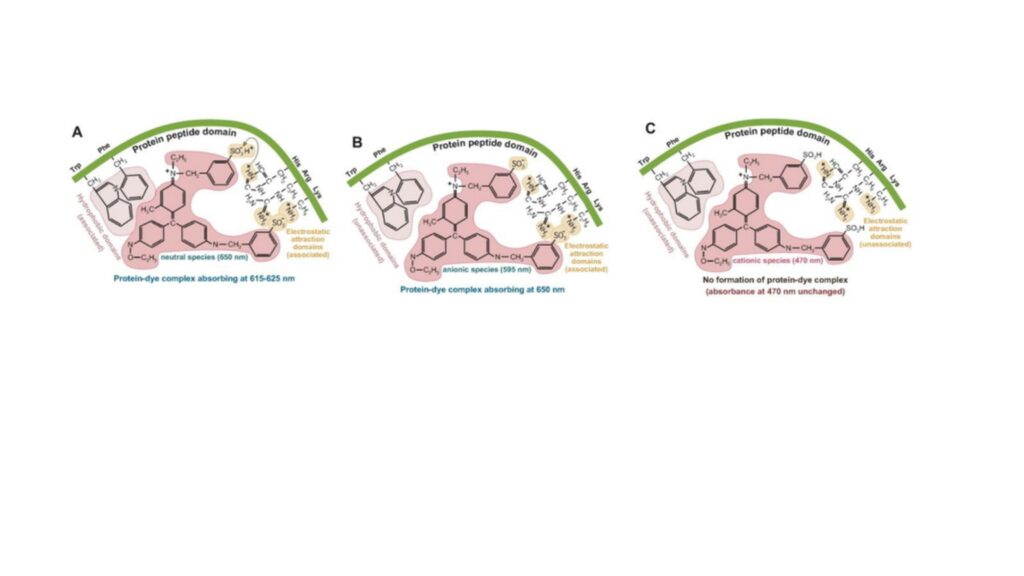
کوماسی آبی درخشان Coomassie Brilliant Blue (CBB) (به اختصار کوماسی آبی) پرکاربردترین روش رنگآمیزی پروتئین در ژل است. کوماسی آبی از زمانهای قدیم برای رنگآمیزی پشم استفاده شده است. این رنگ به سادگی با بازرسی چشمی قابل تشخیص است و کار با آن نسبتاً آسان است. CBB R-250 و مشتق دیمتیل CBB G-250 رنگهای تریفنیل متان دیسولفونه هستند که باندهای پروتئینی را به رنگ آبی روشن رنگآمیزی میکنند. این رنگها از طریق برهمکنش الکترواستاتیکی به اسیدهای آمینه بازی پروتونه (لیزین، آرژنین و هیستیدین) و نیز ازطریق پیوندهای آبگریز به باقیماندههای آروماتیک پروتئیندر ژل متصل میشوند. این رنگها به ژل پلیآکریل آمید متصل نمیشوند، اما در بستر ژل نفوذ میکنند که می توان با رنگبری آن را حذف نمود. روش رنگآمیزی کوماسی آبی بسیار آسان، پرکاربرد، کم هزینه و دارای حساسیت نسبی (2/0 تا 5/0 میکروگرم در هر باند) است. بعلاوه، چگالی رنگ رابطه مناسبی با مقدار باندهای پروتئین دارد. با این حال، مراحل رنگآمیزی و رنگبری در این روش به زمان و چند معرف نیاز دارد.
در شکل کلوئیدی کوماسی آبی، رنگ به طور خاص به باندهای پروتئینی متصل می شود، و به طور مؤثر وارد بستر ژل نمیشود. لذا حساسیت بالاتری نسبت به روش استاندارد رنگآمیزی CBB R-250 دارد ولی زمینه ژل هم کمی رنگ میپذیرد. برای رنگآمیزی کلوئیدی کوماسی، CBB G-250 به CBB R-250 ترجیح داده میشود. پس از رنگآمیزی، ژل با آب شسته میشود تا رنگ زمینهی ژل کاهش یابد. باندهای پروتئینی در چند دقیقه اول قابل مشاهده هستند و زمینه در ابتدا شفاف و در نهایت آبی ضعیف است.
رنگآمیزی با نقره، روش جایگزین برای افزایش حساسیت تشخیص پروتئین نسبت به رنگآمیزی کوماسی آبی است. گروههای واکنشدهنده اصلی که در واکنشهای رنگآمیزی نقره دخیل هستند، آمینهای آزاد و گروههای گوگرد موجود در پروتئینها هستند. برخی اشکال روش نقره در حال حاضر حساسترین روش رنگآمیزی پروتئین در ژل هستند. با این حال، روشهای رنگآمیزی نقره بطورکلی چند مرحلهای هستند و تحت تأثیر کیفیت معرف و همچنین زمان انکوباسیون و ضخامت ژل قرار دارند. روشهای رنگآمیزی نقره را میتوان به سه دسته اصلی تقسیم کرد: رنگهای نقره آمونیاکی یا دیآمین، رنگهای نقره غیرآمونیاکی و رنگهای نقره احیای نوری (photoreduction). رنگهای نقره آمونیاکی برای رنگآمیزی پروتئینهای جدا شده در ژلهای ضخیمتر از یک میلیمتر مفید هستند. رنگهای نقره غیرآمونیاکی معمولاً سریعتر از رنگهای نقره آمونیاکی هستند و با ژلهای با ضخامت یک میلیمتر یا نازکتر کارایی بهتری دارند. رنگ های نقره با احیای نوری سریعترین روش نقره هستند، اما میزان حساسیت کمتری نسبت به سایر روشهای رنگآمیزی نقره دارند. بسیاری از پروتکلهای رنگآمیزی نقره نه تنها پروتئینها، بلکه DNA، لیپوپلیساکاریدهای و پلیساکاریدها را نیز رنگ میکنند. از طرف دیگر، تمام رنگهای نقره همه پروتئینها را شناسایی نمیکنند. برای مثال، رنگآمیزی کالمودولین و تروپونین C با برخی از روشهای رنگ آمیزی نقره دشوار است. به نظر میرسد پیش تیمار این پروتئینها با گلوتارآلدئید توانایی آنها را برای رنگآمیزی افزایش میدهد.
رنگهای نقره آمونیاکی به تثبیت یونهای نقره با تشکیل کمپلکسهای دی آمین نقره با هیدروکسید آمونیوم متکی هستند. غلظت یون نقره معمولاً در این رنگها بسیار کم است، زیرا بیشتر نقره در کمپلکسهای دی آمین متصل میشود. در این رنگها، محلول نقره آمونیاکی معمولاً با اسید سیتریک اسیدی میشود تا قابل رویت گردد. افزودن اسید سیتریک، غلظت یونهای آمونیوم آزاد را کاهش میدهد و در نتیجه یونهای نقره را تا حدی آزاد میکند که احیای آنها توسط فرمالدئید به نقره فلزی امکانپذیر گردد. غلظت بهینه اسید سیتریک نیز منجر به احیای یون نقره به صورت کنترلشده میشود و از رسوب غیرانتخابی نقره جلوگیری میکند.
رنگ های نقره غیرآمونیاکی نسبتا ساده و سریع هستند. آنها بر واکنش نیترات نقره با سایتهای پروتئینی در شرایط اسیدی و به دنبال آن احیای انتخابی یون نقره به نقره فلزی توسط فرمالدئید در شرایط قلیایی متکی هستند.
رنگهای احیای نوری از انرژی فوتونهای نور برای احیای نقره یونی به فلز استفاده میکنند. روش رنگآمیزی با رنگهای نقره احیای نوری یک روش سریع و ساده برای تشخیص پروتئینها است. این روش امکان مشاهدهی الگوهای پروتئین را در 10 دقیقه پس از جداسازی در الکتروفورز فراهم میکند. اما این روش فاقد حساسیت سایر روشهای رنگآمیزی نقره است و برای مطالعهی باندها یا لکههای پروتئینی متراکم استفاده میشود. بطورکلی، نگهداری ژلهایی که با سایر روشهای نقره رنگآمیزی شدهاند، بخوبی امکان پذیر است، در حالیکه نگهداری از ژلهای رنگآمیزی شده با رنگ نقرهی احیای نوری دشوار است و تنها ذخیره سازی این ژلها با عکس گرفتن از آنها امکانپذیر است.
بیشتر پروتئین ها در رنگ آمیزی نقره به رنگ های قهوه ای یا سیاه دیده میشوند. درحالیکه، رنگ تولیدشده توسط رنگهای نقره با لیپوپروتئینها مایل به رنگ آبی است و برخی از گلیکوپروتئین ها زرد، قهوه ای یا قرمز به نظر میرسند. این اثر رنگ به دلیل پراکندگی پراش نور توسط دانههای میکروسکوپی نقره است و یک وابستگی واضح و قابل تکرار بین رنگ و اندازه دانههای نقره وجود دارد.
چندین روش رنگ آمیزی دیگر وجود دارد که در آنها از کاتیونهای فلزی برای رنگآمیزی سریع پروتئینها بدون بکاربردن تثبیت کنندهها یا رنگهای آلی استفاده میشود. روش رنگآمیزی معکوس با فلز روی از توانایی اتصال پروتئینها و کمپلکسهای پروتئین –SDS در اتصال به Zn +2 و جداکردن Zn +2 در محیط و تشکیل رسوب روی ایمیدازول (ZnIm2) برای ایجاد یک پس زمینهی مات بهره میبرد. روش رنگآمیزی معکوس با فلز روی بر خلاف سایر روشهای رنگآمیزی است زیرا یک رنگآمیزی منفی است. این روش به جای رنگ آمیزی پروتئینها، تمام قسمت هایی از ژل پلی آکریل آمید را که در آن پروتئین وجود ندارد، رنگ میکند. کمپلکسهای روی با ایمیدازول در ماتریکس ژل رسوب میکند و جایی که پروتئین اشباع شده با SDS وجود دارد، بیرنگ و شفاف می ماند. از مزایای این روش حساسیت آن است، به نحوی که 25/0 نانوگرم پروتئین را در هر باند را تشخیص می دهد و زمان رنگ آمیزی در 15 دقیقه کامل می شود. پاک کردن رنگ از روی ژل امکان پذیر است تا به راحتی بتوان پروتئینها را بازیابی نمود. از معایب این روش این است که باندهای پروتئینی شفاف در برابر پسزمینه مات، کنتراست رنگ سنجی چشمگیر رنگ آمیزی کوماسی یا نقره را ندارد.
رنگآمیزی فلورسانس پروتئین در ژل، در کنار یک دستگاه آشکار ساز مناسب، روشی حساس و کمی برای آنالیز پروتئین است. رنگهای فلورسانس در ژل مزایایی مانند سهولت استفاده، پایداری نمونه و ایمنی را دارند. رنگهای مختلفی برای رنگآمیزی فلورسانس پروتئینها قبل یا بعد از الکتروفورز وجود دارد. روشهای رنگآمیزی فلورسانس میتوانند حساسیت رنگآمیزی نقره را با مزایای سهولت انجام در رنگآمیزی کوماسی یا یون روی ترکیب کنند و حساسیتی ۱۰ تا ۱۰۰ برابر بیشتر از روشهای رنگسنجی موجود ارائه دهند. این روش تشخیص متکی به دستگاه دقیقی است که به منبع نور تهییجکنندهی تکفام ، فیلتر انتخاب نور و سیستم تشخیص مجهز باشد. برای بسیاری از رنگهای فلورسانس، تشخیص میتواند با بازرسی چشمی، با حساسیت کمتری در مقایسه با روش های تصویر برداری یا ابزار دقیق، انجام پذیرد.
رنگهای فلورسانس به دو دسته کلی تقسیم می شوند: (الف) رنگهای فلوروژنیک که پس از ورود به بستر ژل و همجوار شدن با باندهای پروتئین، افزایش قابل توجه فلورسانس دارند و (ب) رنگ های فلورسانس ذاتی که به طور انتخابی بدون اتصال به بستر ژل به باندهای پروتئینی متصل می شوند. رنگ های فلورسانسSYPRO Orange، SYPRO Red، SYPRO Tangerine و SYPRO Ruby رنگ های فلورسانس یک مرحله ای هستند که برای رنگ آمیزی سریع و کارآمد پروتئین در ژلهای یکبعدی بکار میروند. این رنگها حساسیتی معادل روش رنگ آمیزی نقره برای ژلهای یکبعدی دارند و تشخیص پروتئینها را به گونهای که تحت تأثیر حضور اسیدهای نوکلئیک و لیپوپلی ساکاریدها قرار نگیرند، میسر میسازند.
در رنگ آمیزی فلورسانس، پس از SDS-PAGE، ژل در محلول رنگآمیزی قرار میگیرد. سپس ژل برای حذف رنگهای اضافی با آب شسته می شود و رنگآمیزی را میتوان با قراردادن ژل در جعبه نور UV مشاهده کرد. رنگآمیزی پروتئینها و رنگبری در این روش سریع و آسان است و بیشتر زمان لازم رنگآمیزی، صرف کاهش رنگ پسزمینه ژل در مرحلهی رنگبری میشود. روش های رنگآمیزی فلورسانس پروتئین در ژل، بسیار حساس و دارای سیگنال ثابت هستند.
SYPRO Ruby یک کیلات فلزی روتنیم است که به اسیدهای آمینه بازی در پروتئینها متصل میشود و برخلاف سایر رنگهای SYPRO، تداخلی با میسلهای SDS ندارد. اتصال رنگ از طریق برهمکنش مستقیم الکترواستاتیکی با باقیماندههای اسید آمینه بازی توسط مکانیسمی شبیه به کوماسی آبی درخشان کلوئیدی انجام میشود. روش رنگآمیزی ساده است و اجازه میدهد تا در مطالعات پروتئومی با توان عملیاتی بالا و مقیاس بزرگ ازآن استفاده نمود. در این روش از رنگ آمیزی فلورسانس، تهییج با نور UV و یا اسکنر لیزری صورت می گیرد. این روش شدت، پایداری، حساسیت تشخیص و سهولت استفادهی بالایی دارد. به همین دلیل باعث شده تا SYPRO Ruby به استانداردی برای مقایسهی رنگهای توسعه یافتهی پروتئینی در ژل تبدیل شود.
رنگ Nile red که به Nile blue oxazone نیز شناخته میشود، یک رنگ فنوکسازون است که پس از انتقال از محیطهای آبی به محیطهای آبگریز مانند میسل های SDS یا کمپلکس های پروتئین-SDS، افزایش فلورسانس قابل توجهی دارد. این رنگ برهمکنش قابل توجهی با مونومرهای SDS ندارد و از این ویژگی، برای ایجاد یک روش رنگآمیزی سریع پروتئین برای ژلهای SDS استفاده میشود. در این روش، رنگ به سرعت در آب رسوب میکند به طوری که رنگآمیزی در 2 تا 5 دقیقه انجام و پس از رنگ آمیزی، ژل برای مدت کوتاهی با آب شسته میشود. در این روش، تهییج می تواند با نور UV یا نور سبز صورت میگیرد و باندهای پروتئینی قرمز کم رنگ بهنظر میرسند. حساسیت رنگآمیری با Nile red مشابه کوماسی آبی است. از آنجایی که در این روش مرحله ی تثبیت وجود ندارد، ژل های رنگآمیزی شده با رنگ Nile red را میتوان متعاقباً بهخوبی الکتروبلات نمود. پسزمینه فلورسانس بالا و پایداری نور از مشکلاتی هستند که در این تکنیک میتوان با آنها مواجه شد.
Epicocconone از دیگر رنگهای فلورسانس است که برای رنگآمیزی پروتئین در ژل پلی آکریل آمید بکار میرود. این ترکیب یک آزافیلون (azaphilone) است که از قارچ Epicoccum nigrum جدا میشود. این رنگ تقریباً بلافاصله با آمینهای اولیه وآمونیاک واکنش می دهد و ترکیبات فلورسانس قرمز تولید میکند. این روش رنگآمیزی فلورسانس پروتئین، سریع و فوق العاده مناسب برای ژل های پروتئینی و بلات میباشد و دارای رنگ پسزمینه ناچیزی است. این رنگ با طیف سنجی جرمی، توالی یابی Edman و سیستم Ettan™ DIGE سازگاری بالایی دارد و همچنین سازگار با محیط زیست و عاری از فلزات سنگین است.
اتورادیوگرافی یکی دیگر از روش های رنگ آمیزی پروتئین در ژل است که در آن تششعات رادیواکتیو ناشی از باندهای پروتئین روی فیلم عکاسی ظاهر میشود. بطورکلی، از این روش در انواعی از روش های آزمایشگاهی همچون نورترن بلات، ساترن بلات و تشخیص پروتئینهای رادیواکتیو در ژل SDS-PAGE استفاده میشود. ایزوتوپهای گوگرد 35 و فسفر 32 رایجترین ایزوتوپهای مورد استفاده در اتورادیوگرافی هستند. گوگرد 35 یک ساطع کنندهی ذرات بتا با انرژی نسبتا کم (167/0 مگا الکترون ولت) است. بنابراین، ذرات ساطع شده از گوگرد 35 تا عمق 22/0 میلیمتر به یک لایه نفوذ میکنند که معمولاً برای برهمکنش با امولسیون موجود در فیلم، تا زمانی که فیلم و منبع رادیواکتیویته در تماس مستقیم و بدون مانع هستند، کافی است. در این حالت، ژل باید قبل از اتورادیوگرافی کاملاً خشک شون تا در تماس مستقیم با فیلم قرار بگیرد. فسفر 32 یک تابشگربتا با انرژی 71/1 مگا الکترون ولت است. بنابراین، ذرات آن تا عمق 6 میلیمتری در آب یا مواد دیگر نفوذ و به طور کامل از یک فیلم عبور میکند. در این مورد، ژل یا غشا نیازی به خشک شدن ندارد، زیرا آب انرژی این ذرات را مسدود نمیکند. کارایی ذرات بتای ساطعشده از فسفر 32هنگامی که یک صفحه تشدید کننده در پشت فیلم اشعه ایکس قرار دارد، افزایش مییابد، زیرا ذرات رادیواکتیو که از فیلم عبور میکنند باعث میشوند صفحه تشدیدکننده فوتونهایی منتشر کند که امولسیون فیلم را حساس نماید. استفاده از صفحه تشدید کننده منجر به شدت پنج برابری ذرات ساطع شده میشود. هنگامی که اتورادیوگرافی در دمای پایین (-70 درجه سانتیگراد) انجام میشود، وضوح تصویر افزایش می یابد. صفحات تنگستات کلسیم از تشدیدکنندههای مناسب است، زیرا نور آبی ساطع میکند که فیلم های اشعه ایکس به آن بسیار حساس هستند .
بطورکلی، روش های مختلفی برای رنگآمیزی پروتئینها در ژل وجود دارد که الگوهای پروتئینی به دست آمده در هر روش ممکن است بسته به مکانیسمهای تشخیص و روشهای اعمال شده، متفاوت باشد. از این رو، انتخاب روش رنگآمیزی متناسب با کاربردهای پایین دستی برنامه ریزی شده، ضروری است و هنگام انتخاب یک روش رنگآمیزی باید به ترکیب پروتئینهای نمونه، وجود یا عدم وجود اسیدهای آمینه منفرد، در دسترس بودن نمونه و استفاده پس از رنگ آمیزی پروتئین در ژل توجه داشت.
منابعی برای مطالعه بیشتر
– Sasse J, Gallagher SR. Staining Proteins in Gels. Current Protocols in Molecular Biology (2003) 10.6.1-10.6.25. doi.org/10.1002/0471142727.mb1006s63. Copyright © 2003 by John Wiley & Sons, Inc.
– Circolo A, Gulati S. Autoradiography and Fluorography of Acrylamide Gels. The Protein Protocols Handbook, pp 595-603. DOI: 10.1007/978-1-59745-198-7_56. Edited by: J.M. Walker © Humana Press, a Part of Springer Science + Business Media, LLC 2009.

